NIRS – NahInfraRotSpektroskopie
Die Innovative Methode zur Leistungsdiagnostik und Trainingssteuerung
Wie funktioniert NIRS?
NIRS sendet Licht nahe dem Infrarotspektrum in das Gewebe und misst die Reflexion des Lichts. Der Moxy verfügt über einen „Sender“, der das Licht etwa 15mm tief durch die Haut sowie das Unterhautfettgewebe in die Muskulatur sendet und 2 „Empfänger“, die die Reflexionen messen.
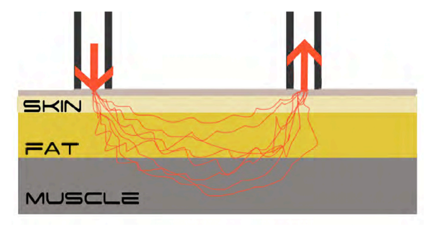
Die Menge des reflektierten Lichts hängt dabei vor allem von den lichtabsorbierenden Molekülen im untersuchten Gewebe ab. Im Falle des Skelettmuskels sind dies im Wesentlichen die Eisenverbindungen des Hämoglobins und Myoglobins, die in Abhängigkeit von der Verbindung mit Sauerstoff mehr oder weniger Licht reflektieren. Dementsprechend kann NIRS dazu eingesetzt werden, die Konzentration und Sauerstoffsättigung des Hämoglobins und Myoglobins im untersuchten Gewebe zu messen, wobei sich das Hämoglobin in den Mikrogefäßen um den Muskel herum und das Myoglobin im Muskel selbst befindet. Einflussfaktoren auf die Messung sind Hämoglobinkonzentration des Bluts, Kapillarisierung, Muskelfaserzusammensetzung, Dicke des Unterhautfettgewebes sowie Hautpigmentierung. Je höher die Hämoglobinkonzentration des Bluts sowie die Kapillarisierung, desto mehr Hämoglobin im Blut und entsprechend auch mehr Sauerstoff können zum Muskel transportiert werden. Langsame Muskelfasern verfügen über eine höhere Konzentration an Myoglobin als schnelle Muskelfasern. Somit ist das gemessene Hämoglobin bei einem hohen Anteil langsamer Fasern höher als bei einem hohen Anteil schneller Fasern. Die Dicke des Unterhautfettgewebes sowie die Stärke der Hautpigmentierung beeinflussen, wieviel Licht den Muskel und seine umliegenden Gefäße erreichen kann. Je dicker das Unterhautfettgewebe, desto weniger Blutgefäße und Muskeln werden vom ausgesandten Licht erreicht. Je stärker die Hautpigmentierung, desto weniger Licht dringt durch die Haut.
Was misst NIRS?
Genaugenommen misst NIRS die Konzentration und Sauerstoffsättigung des Hämoglobins und Myoglobins.
Zum Verhältnis des Anteils am NIRS-Signal zwischen Hämoglobin (Hb) und Myoglobin (Mb) existieren verschiedene Aussagen. Manche Studien gehen von einem überwiegenden Anteil des Hb aus (Mancini 1997b). Andere wiederum von einem überwiegenden Anteil des Mb (Marcinek et al. 2007). Unabhängig vom Anteil am NIRS-Signal weisen die Anteile von Hb und Mb intraindividuelle Schwankungen auf. So ist die Konzentration des Mb in Typ I-Muskelfasern höher als in Typ II-Muskelfasern (van Beek-Harmsen et al. 2004; Nemeth and Lowry 1984), wodurch der Anteil am Gesamtsignal durch die Verteilung der Muskelfasern beeinflusst wird. Des Weiteren konnte gezeigt werden, dass der Einfluss des Hb auf das NIRS-Signal eine Funktion des mikrovaskulären Volumens sowie des mikrovaskulären Hämatokrits ist (Barstow 2019). Je besser also die Kapillarisierung, desto größer der Anteil des Hb am NIRS-Signal. Dieser Zusammenhang spiegelt sich auch oder insbesondere unter Belastung wider. Aufgrund der zunehmenden Durchblutung unter Belastung steigt der Anteil des Hb am NIRS-Signal an (Davis and Barstow 2013). Somit unterscheiden sich die Anteile des Hb und Mb am NIRS-Signal nicht nur statisch (Muskelfaserzusammensetzung, Kapillarisierung), sondern auch dynamisch (Aktivität).
Aufgrund der gängigen Nomenklatur und zur Vereinfachung der Darstellung nutzen wir im Folgenden den Bezug zum Hb, wobei wir uns darüber im Klaren sind, dass es sich immer um die Summe aus Hb + Mb handelt.
Aus der Messung lassen sich vier Basisvariablen ableiten: Sauerstoffsättigung (SmO2), mit Sauerstoff angereichertes Hb (Oxy-Hb), nicht mit Sauerstoff angereichertes Hb (Deoxy-Hb), totales Hb (tHb), sowie daraus abgeleitete Variablen. Die Basisvariablen werden nachfolgend kurz erläutert.
- Sauerstoffsättigung (SmO2)
Die Sauerstoffsättigung repräsentiert die Konzentration des mit Sauerstoff besetzten Hämoglobins im untersuchten Gewebe. Sie stellt somit die Balance zwischen Sauerstoffangebot und Sauerstoffverbrauch des Skelettmuskels dar. - Totales Hämoglobin (tHb)
Veränderungen des totalen Hämoglobins repräsentieren Veränderungen des kapillaren Hämatokrits und dienen dadurch als Indikator für die lokale Durchblutung (Barstow 2019). Somit repräsentiert ein Anstieg des tHb eine gesteigerte Durchblutung und umgekehrt. Ein Abfall des tHb kann zum Beispiel durch eine geringe Trittfrequenz in Kombination mit hohem Drehmoment und die dadurch verursachte Unterbrechung des lokalen Blutflusses, ausgelöst werden. - Oxyhämoglobin (O2Hb)
Oxyhämoglobin beschreibt das mit Sauerstoff angereicherte Hämoglobin und repräsentiert das lokale Sauerstoffangebot des Skelettmuskels. Es setzt sich daher aus der aktuellen Sauerstoffsättigung und der Veränderung des totalen Hämoglobins zusammen. - Deoxyhämoglobin (HHb)
Deoxyhämoglobin ist das nicht mit Sauerstoff angereicherte Hämoglobin. Es reflektiert den metabolischen Sauerstoffbedarf des Muskels (Wang et al. 2006).
In zahlreichen Studien konnte nachgewiesen werden, dass die NIRS-Technologie dazu genutzt werden kann die individuelle anaerobe Schwelle, die Laktatschwelle, den Punkt der respiratorischen Kompensation (RCP) sowie das Laktatgleichgewicht zu bestimmen (Bellotti et al. 2013; Fontana et al. 2015; Keir et al. 2015; Wang et al. 2006).
Darüber hinaus konnten mehrere Studien nachweisen, dass eine enge Korrelation zwischen NIRS-Parametern und den energiereichen Phosphaten (z.B. Kreatinphosphat) besteht (McCully et al. 1994; Ryan et al. 2013).
Somit kann die NIRS-Technologie als eine verlässliche Messmethode gesehen werden, die zahlreiche Rückschlüsse auf die zugrunde liegenden physiologischen Prozesse ermöglicht.
Literatur
Bellotti, Cecilia; Calabria, Elisa; Capelli, Carlo; Pogliaghi, Silvia (2013): Determination of maximal lactate steady state in healthy adults: can NIRS help? In Medicine and science in sports and exercise 45 (6), pp. 1208–1216. DOI: 10.1249/MSS.0b013e3182828ab2.
Davis, Michelle L.; Barstow, Thomas J. (2013): Estimated contribution of hemoglobin and myoglobin to near infrared spectroscopy. In Respiratory physiology & neurobiology 186 (2), pp. 180–187.
Fontana, Federico Y.; Keir, Daniel A.; Bellotti, Cecilia; Roia, Gabriela F. de; Murias, Juan M.; Pogliaghi, Silvia (2015): Determination of respiratory point compensation in healthy adults: Can non-invasive near-infrared spectroscopy help? In Journal of science and medicine in sport 18 (5), pp. 590–595. DOI: 10.1016/j.jsams.2014.07.016.
Keir, Daniel A.; Fontana, Federico Y.; Robertson, Taylor C.; Murias, Juan M.; Paterson, Donald H.; Kowalchuk, John M.; Pogliaghi, Silvia (2015): Exercise Intensity Thresholds: Identifying the Boundaries of Sustainable Performance. In Medicine and science in sports and exercise 47 (9), pp. 1932–1940. DOI: 10.1249/MSS.0000000000000613.
Mancini, D. (1997a): Application of near infrared spectroscopy to the evaluation of exercise performance and limitations in patients with heart failure. In Journal of biomedical optics 2 (1), pp. 22–30. DOI: 10.1117/12.263747.
Mancini, D. (1997b): Application of near infrared spectroscopy to the evaluation of exercise performance and limitations in patients with heart failure. In Journal of biomedical optics 2 (1), pp. 22–30. DOI: 10.1117/12.263747.
Marcinek, David J.; Amara, Catherine E.; Matz, Kimberly; Conley, Kevin E.; Schenkman, Kenneth A. (2007): Wavelength shift analysis: a simple method to determine the contribution of hemoglobin and myoglobin to in vivo optical spectra. In Applied spectroscopy 61 (6), pp. 665–669.
McCully, K. K.; Iotti, S.; Kendrick, K.; Wang, Z.; Posner, J. D.; Leigh, J.; Chance, B. (1994): Simultaneous in vivo measurements of HbO2 saturation and PCr kinetics after exercise in normal humans. In Journal of applied physiology (Bethesda, Md. : 1985) 77 (1), pp. 5–10. DOI: 10.1152/jappl.1994.77.1.5.
Nemeth, P. M.; Lowry, O. H. (1984): Myoglobin levels in individual human skeletal muscle fibers of different types. In The journal of histochemistry and cytochemistry : official journal of the Histochemistry Society 32 (11), pp. 1211–1216. DOI: 10.1177/32.11.6491255.
Ryan, Terence E.; Southern, W. Michael; Reynolds, Mary Ann; McCully, Kevin K. (2013): A cross-validation of near-infrared spectroscopy measurements of skeletal muscle oxidative capacity with phosphorus magnetic resonance spectroscopy. In Journal of applied physiology (Bethesda, Md. : 1985) 115 (12), pp. 1757–1766. DOI: 10.1152/japplphysiol.00835.2013.
van Beek-Harmsen, Brechje J.; Bekedam, Martijn A.; Feenstra, H. Maria; Visser, Frans C.; van der Laarse, Willem J. (2004): Determination of myoglobin concentration and oxidative capacity in cryostat sections of human and rat skeletal muscle fibres and rat cardiomyocytes. In Histochemistry and cell biology 121 (4), pp. 335–342.
Wang, Lixin; Yoshikawa, Takahiro; Hara, Taketaka; Nakao, Hayato; Suzuki, Takashi; Fujimoto, Shigeo (2006): Which common NIRS variable reflects muscle estimated lactate threshold most closely? In Applied physiology, nutrition, and metabolism = Physiologie appliquee, nutrition et metabolisme 31 (5), pp. 612–620. DOI: 10.1139/h06-069.
